A Osmose no Sangue
No sangue encontramos células como os eritrócitos e leucócitos. Estes componentes celulares do sangue estão separados fisicamente do ambiente aquoso que os rodeia por membranas que são bastante seletivas quanto aos tipos de espécies que elas deixam penetrar ou abandonar as células. Em geral, estas membranas são bastante permeáveis às moléculas de água.
Se os eritrócitos forem retirados de seu ambiente aquoso normal e colocados em água destilada, as células incharão gradativamente e eventualmente se romperão, libertando seu pigmento vermelho. Isto é causado pela difusão de água, através da membrana celular, para dentro da célula. Por outro lado, se os eritrócitos forem adicionados à uma solução aquosa salina, o efeito oposto é observado. A água difunde-se para fora das células, ocorrendo o enrugamento.
As membranas celulares e vegetais, como os animais, agem de forma similar. Flores imersas em soluções aquosas de açúcar ou sal murcham, mas se transferidas para a água pura, elas recuperam seu frescor.
Os fenômenos descritos acima são chamados de osmose. Neste fenômeno intervém uma membrana semipermeável, que é uma película cujos poros são suficientemente grandes para permitir a passagem de moléculas de solvente, mas suficientemente pequenos para impedir a passagem de moléculas de soluto.
Explicando a osmose e a pressão osmótica
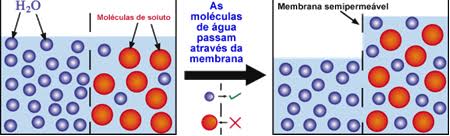 Para entendermos detalhadamente o fenômeno da osmose e o que é pressão osmótica, consideremos um recipiente contendo uma solução aquosa de glicose separada de água pura por um meio de uma membrana permeável às moléculas de água e impermeável às de glicose, ou seja, semipermeável. Em vista disso, haverá uma passagem de moléculas de água tanto da solução aquosa de glicose para a água pura como no sentido inverso.
Para entendermos detalhadamente o fenômeno da osmose e o que é pressão osmótica, consideremos um recipiente contendo uma solução aquosa de glicose separada de água pura por um meio de uma membrana permeável às moléculas de água e impermeável às de glicose, ou seja, semipermeável. Em vista disso, haverá uma passagem de moléculas de água tanto da solução aquosa de glicose para a água pura como no sentido inverso.
Observa-se, após certo tempo, que o nível de água pura diminui e o nível da solução aquosa de glicose aumenta, indicando que as moléculas de água passam mais rapidamente da água pura para a solução do que no sentido inverso.
O fluxo de moléculas de água no sentido solvente-solução é, inicialmente, mais rápido do que no sentido inverso. Isto pode ser explicado levando-se em conta que a pressão de vapor do solvente puro (P0) é maior que a pressão de vapor deste solvente na solução (P). À medida em que o solvente passa para a solução, esta vai se tornando cada vez mais diluída e o valor de P vai aumentando, pois quanto mais diluída uma solução, maior o valor de P.
Quando a pressão de vapor do solvente na solução (P) se igualar à pressão de vapor do solvente puro (P0), os fluxos das moléculas nos dois sentidos se igualam, equilibrando o sistema. Não há mais alteração nos níveis das soluções.
Da osmose para a pressão osmótica: entenda o conceito
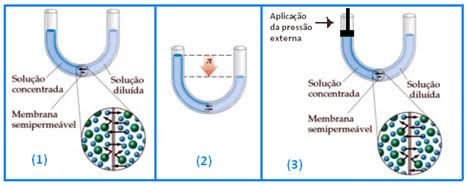 Conforme mencionado, inicialmente o fluxo de moléculas do solvente no sentido solvente puro- solução é maior que no sentido contrário. Pode-se impedir esse fluxo aplicando uma pressão externa suficiente sobre a solução. Esta pressão extra deve ser aplicada à solução a fim de evitar tal fluxo através da membrana conhecida como pressão osmótica da solução. A diferença de nível que se estabelece entre o solvente puro e sua solução pode ser utilizada para medir a pressão osmótica desta solução.
Conforme mencionado, inicialmente o fluxo de moléculas do solvente no sentido solvente puro- solução é maior que no sentido contrário. Pode-se impedir esse fluxo aplicando uma pressão externa suficiente sobre a solução. Esta pressão extra deve ser aplicada à solução a fim de evitar tal fluxo através da membrana conhecida como pressão osmótica da solução. A diferença de nível que se estabelece entre o solvente puro e sua solução pode ser utilizada para medir a pressão osmótica desta solução.
Esquema de pressão osmótica em soluções de concentrações diferentes
O fenômeno de osmose também é observado quando se tem duas soluções de concentrações diferentes, separadas por uma membrana semipermeável; o fluxo do solvente através da membrana é mais intensamente verificado da solução diluída (maior pressão de vapor) para a solução concentrada (menor pressão de vapor).
Expressão de Van’t Hoff
A pressão de vapor de uma solução diluída de soluto não volátil e não eletrólito pode ser calculada pela expressão de Van’t Hoff. Para solutos eletrólitos, basta acrescentar-se o fator de Van’t Hoff i.
Fórmula de determinação da pressão osmótica

Fórmula de determinação da pressão osmótica
M = molaridade da solução (mol/L);
R = constante universal dos gases perfeitos, que é igual a 0,082 atm . L. mol-1. K-1 ou 62,3 mm Hg L. mol-1. K-1;
T = temperatura absoluta, dada em Kelvin;
C = concentração do soluto (mol/L);
i = fator de Van’t Hoff
Conclusão
- Dessa forma, podemos entender que:
- Para um dado soluto, à temperatura constante, a pressão osmótica é diretamente proporcional à molaridade da solução;
- Para um dado soluto, com a concentração (molaridade) constante, a pressão osmótica π é diretamente proporcional à temperatura absoluta (em Kelvin) da solução.
- Para soluções de solutos eletrólitos, o soluto se dissocia ou se ioniza, aumentando o número de partículas contidas na unidade de volume do solvente, aumentando a pressão.
- Na terminologia biológica e médica, as soluções que têm a mesma pressão osmótica do sangue são chamadas isotônicas; as que têm pressão menores são chamadas hipotônicas, e maiores hipertônicas.
Esquema de influência da pressão osmótica no sangue:

Fontes: Da Silva, R. H. e Da Silva, E.B., Curso de Química 2, 2ª. edição, Editora Harbra Ltda. http://mundoeducacao.bol.uol.com.br/quimica/pressao-osmotica.htm http://alunosonline.uol.com.br/quimica/dessalinizacao-agua-mar-por-osmose-reversa.html



