Cromatografia de Troca Iônica na Biocromatografia
A cromatografia de troca iônica (também conhecida na biocromatografia como IEC ou IEX) envolve a separação de moléculas ionizáveis baseada na sua carga total. Esta técnica permite a separação de moléculas semelhantes, que seriam difíceis de serem separadas por outras técnicas, já que a carga elétrica da molécula de interesse pode ser imediatamente manipulada através de alterações no pH do tampão.
Princípios da cromatografia de troca iônica (IEX)
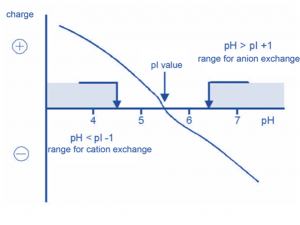
A cromatografia de troca iônica é comumente utilizada para separar moléculas biológicas como peptídeos, proteínas, aminoácidos ou nucleotídeos. Os aminoácidos que constituem as proteínas são compostos zwiteriônicos, ou seja, que contém tanto grupos químicos positivos quanto negativamente carregados. Dependendo do tipo de pH do meio, as proteínas podem apresentar uma carga líquida positiva, negativa ou neutra. O pH no qual a molécula se torna sem carga, ou de carga neutra, é chamado de ponto isoelétrico, ou pI.
Fig. 1. Carga da proteína vs. pH. A ligação entre a estabilidade da proteína e o meio de troca iônica podem variar com a carga total da proteína, que depende do pH.
 O valor de pI pode ser calculado baseado na primeira sequência da molécula. A escolha do pH do tampão então determina a carga líquida da proteína de interesse.
O valor de pI pode ser calculado baseado na primeira sequência da molécula. A escolha do pH do tampão então determina a carga líquida da proteína de interesse.
Em um tampão com pH maior que o pI da proteína de interesse, a proteína irá apresentar carga líquida negativa; portanto, uma resina de troca aniônica positivamente carregada para capturar esta proteína.
Em um tampão com o pH mais baixo que a proteína de interesse, a proteína irá apresentar carga líquida positiva; portanto, uma resina de troca catiônica negativamente carregada é escolhida.
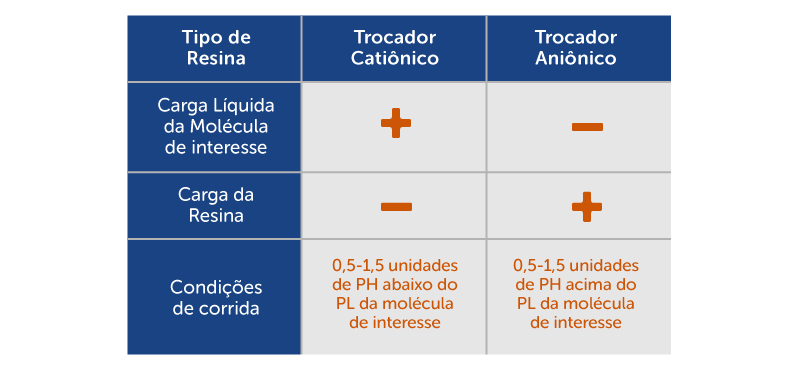
Quando uma coluna de cromatografia de troca iônica é carregada com uma amostra a um determinado pH, todas as proteínas que estão apropriadamente carregadas irão se ligar à resina. Por exemplo, se uma resina de troca aniônica é escolhida, todas as proteínas que são negativamente carregadas no pH do tampão irão se ligar à resina positivamente carregada da coluna. Uma boa regra para o pH do tampão é:
- Trocador de ânions: pH 0,5 a 1,5 unidades acima do pI da proteína de interesse
Funcionamento da Cromatografia de Troca Iônica
Depois de carregar uma amostra impura de proteína em uma coluna de cromatografia de troca iônica, a coluna é lavada para remover as proteínas indesejadas e outras impurezas, e então a proteína de interesse é eluída usando-se um gradiente de sal ou de mudança de pH.
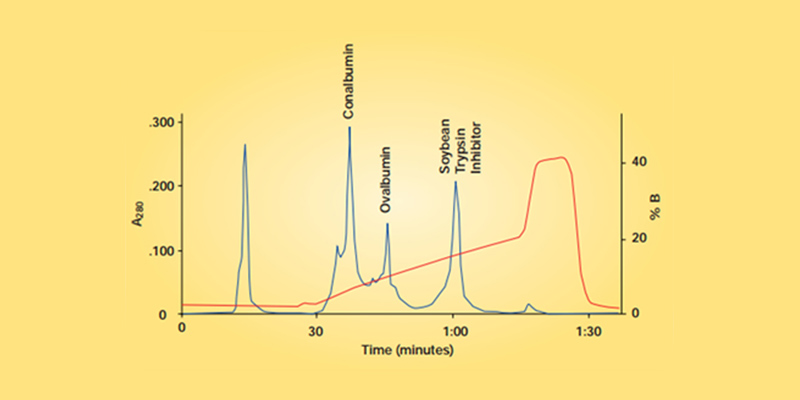
Fig. 3. Eluição com gradiente de sal. Eluição de proteínas (linha azul, cromatograma) com um gradiente crescente de sal (linha vermelha, sinal do condutivímetro)
Os íons carregados de sal competem com as proteínas pelos grupos funcionais carregados nas resinas. Proteínas com poucos grupos carregados irão eluir em baixas concentrações de sal, enquanto proteínas com muitos grupos carregados irão apresentar maiores tempos de retenção e eluir em altas concentrações de sal.
Embora menos comum, o gradiente de pH também pode ser usado para a eluição. Aqui, o gradiente de pH é escolhido de forma a se aproximar do pI da proteína de interesse. Proteínas irão eluir quando o gradiente de pH alcançar o seu pI, porque eles não carregarão mais a carga líquida que os proporciona uma interação com a resina da coluna.
Para eluir proteínas de uma resina de troca aniônica, o gradiente de pH decrescente é escolhido, enquanto um aumento no gradiente de pH é escolhido para eluição de trocadores catiônicos.
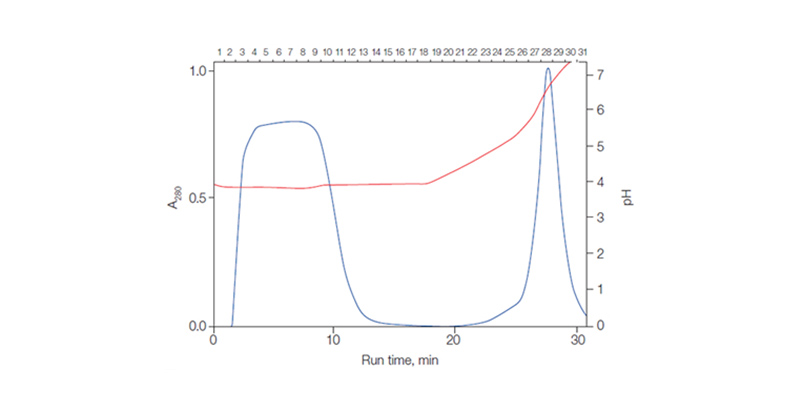
Fig. 4. Eluição de proteína (linha azul) com um aumento no gradiente de pH (linha vermelha, sinal do pHmetro)
Já que é muito difícil gerar gradientes de pH reproduzíveis e precisos, um gradiente de passo é geralmente usado quando o pH é usado para eluição.
Finalmente, o pH pode ser usado para refinar a eluição quando o gradiente de sal é usado. Alterar o pH do tampão de eluição pode afetar a resolução do método:
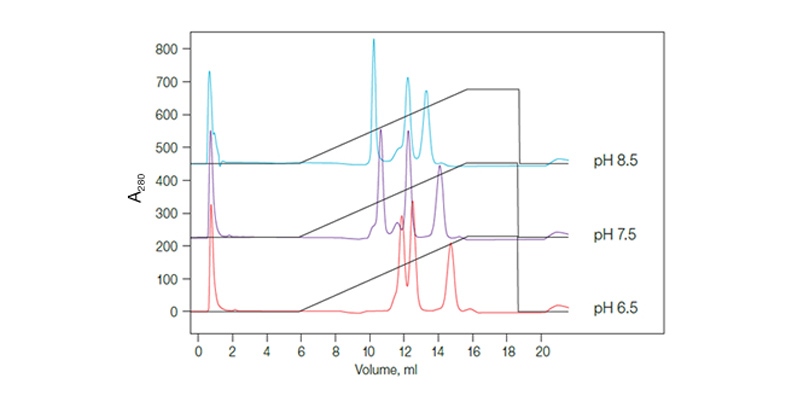
Fig. 5. pH pode alterar a resolução do método. Três cromatogramas sobrepostos mostrando como a mudança do pH de 6,5 para 8,5 altera o perfil de eluição quando um gradiente de sal é utilizado.
Nota: Algumas proteínas caem fora do ponto de equilíbrio em um pH igual ao seu pI. Para essas proteínas, eluição utilizando um gradiente de pH pode não ser possível.