Cromatografia de afinidade de His-Tag é uma das técnicas mais difundidas para a purificação de proteínas recombinantes. Na maior parte dos casos, um passo adicional para limpeza e polimento é necessário. Esta aplicação FPLC destaca a possibilidade de combinar dois protocolos de cromatografia sem intervenção manual usando-se o sistema AZURA Bio LC.
As proteínas fluorescentes, entre as quais a GFP, são muito versáteis e têm sido utilizadas em diversos campos da biologia, como microbiologia, engenharia genética e fisiologia. Elas são extremamente úteis para estudo de expressão génica em culturas de células ou de tecidos, assim como em sistemas vivos (animais, plantas, bactérias…).
Introdução
Cromatografia de afinidade (AC) é uma das técnicas mais eficientes para a purificação de proteínas recombinantes. Basicamente, a cromatografia de afinidade é aplicada em amostras cruas, como lisados de bactérias, que contém proteínas modificadas geneticamente para serem expressas com o tag que permite a captura da proteína recombinante. Esses tags muito eficientes são usados para ligações por afinidade a resinas específicas em colunas de cromatografia por afinidade. Uma grande variedade de tags estão disponíveis, dentre os quais o mais utilizado é o tag de poli-histidina.
Nesta aplicação, seis histidinas (6xHis) foram anexados a proteína verde fluorescente (em inglês, green fluorescente protein – GFP). Os resíduos de histidina se ligam com uma alta afinidade ao íons de metais imobilizados na coluna (em inglês, immobilized metal íon affinity chromatography – IMAC). Em muitos protocolos, um passo adicional é aconselhável para que se atinja uma pureza maior ou para trocar o tampão da proteína purificada por um tampão mais apropriado para armazenagem. No caso em estudo nesta aplicação, a cromatografia por exclusão de tamanho foi usada como segundo passo para troca do tampão da proteína purificada. A purificação de proteínas recombinantes pode ser realizada manualmente ou através de um sistema cromatográfico, que combina os dois passos automaticamente, economizando esforço e tempo.
Resultados
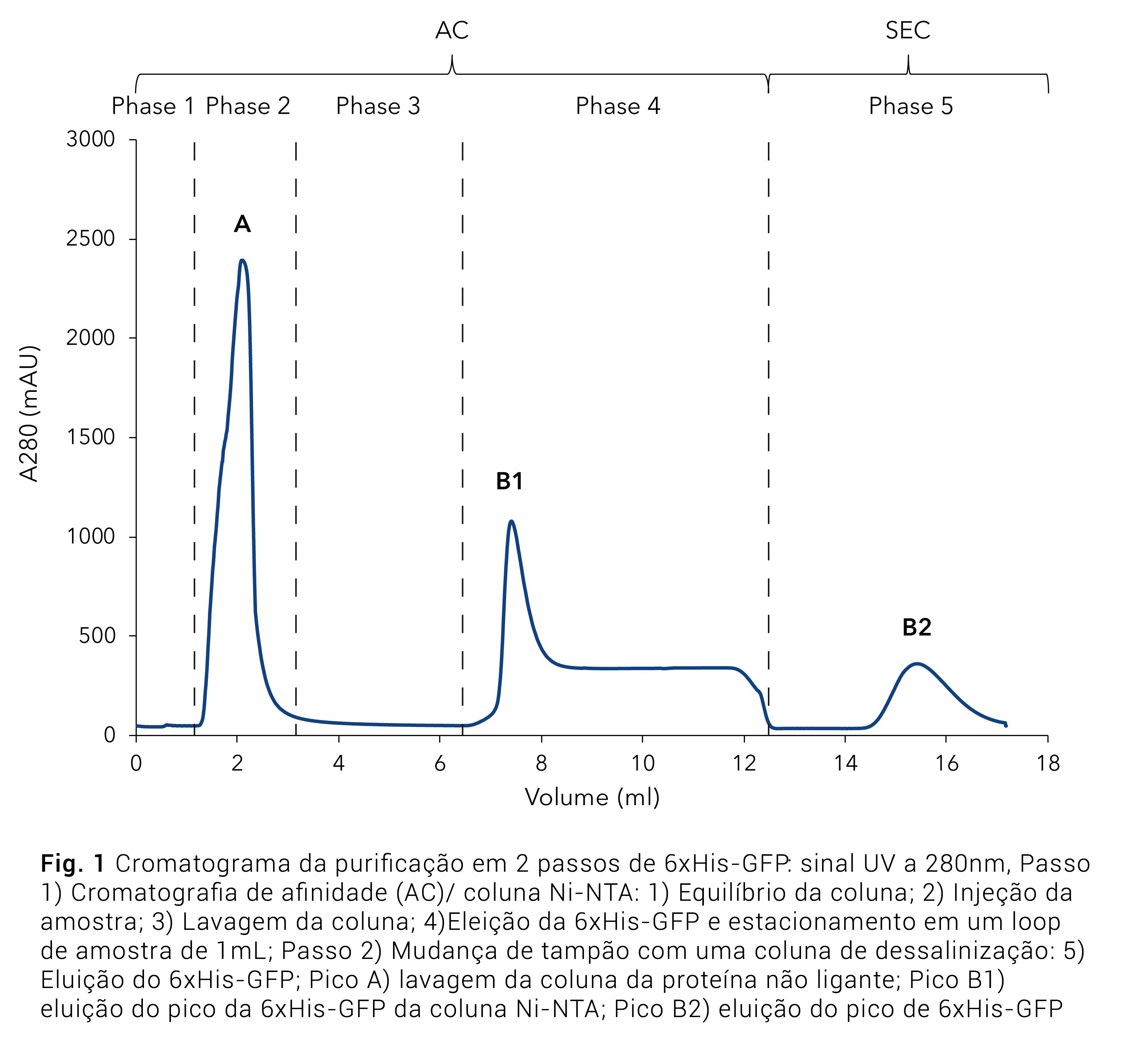
O cromatograma da purificação de 6xHis-GFP mostra as 5 fases do protocolo de 2 passos (Fig.1). Depois do equilíbrio do sistema (Fig. 1, fase 1), o lisado foi injetado e a GFP se ligou à coluna de afinidade Ni-NTA através do 6xHis-tag. Todas as outras proteínas não ligantes e impurezas estão representadas pelo grande pico (Fig. 1, fase 2, pico A). Em seguida, a coluna foi lavada até que a linha de base se estabilizasse (Fig. 1, fase 3). A proteína eluída foi coletada no loop de amostra e re-injetada na coluna de dessalinização (Fig. 1, fase 5) para a troca do tampão de altas concentrações de imidazol para um tapão sem imidazol. A proteína purificada (Fig. 1, pico B2) foi coletada pelo coletor de frações.
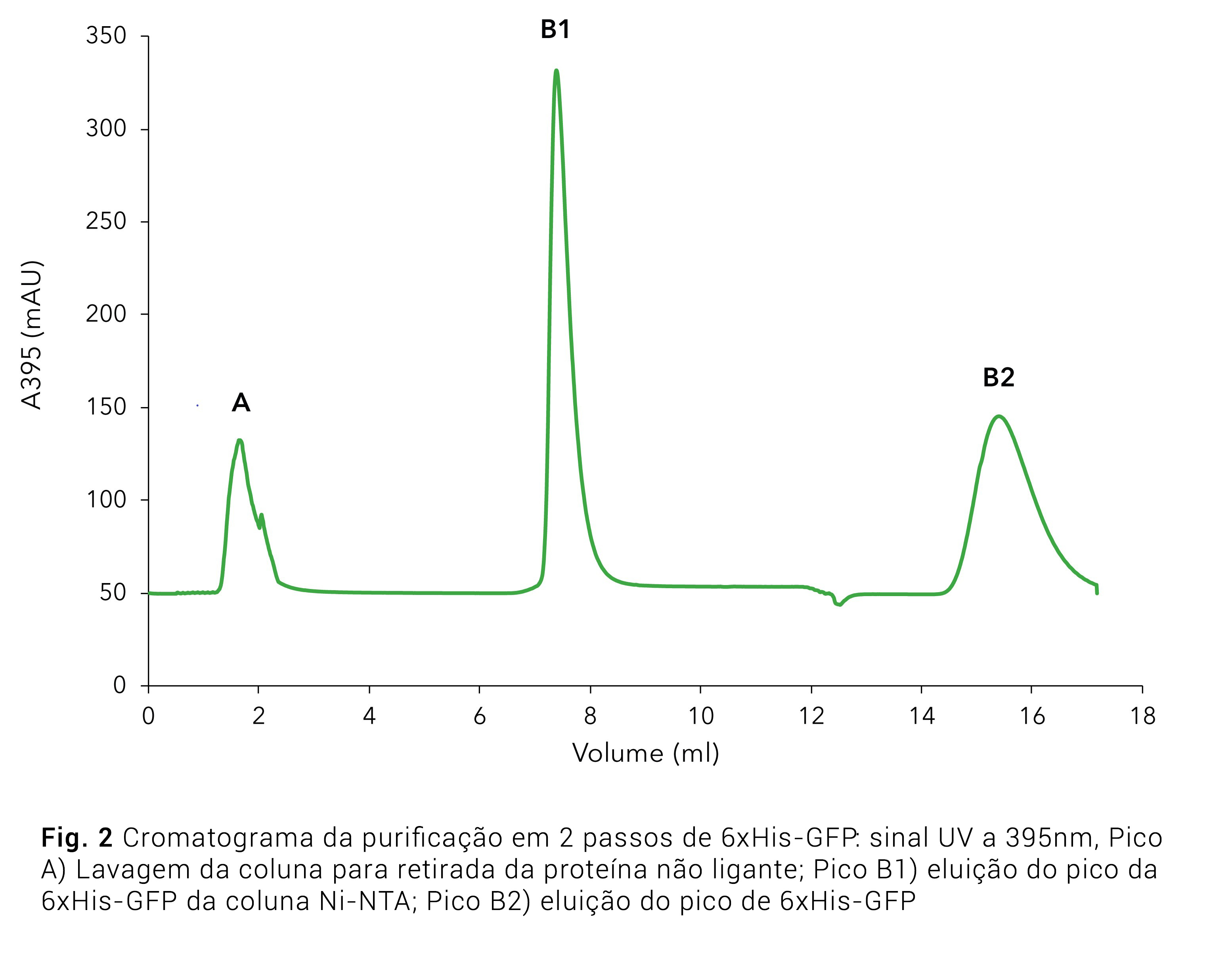
Adicionalmente à detecção fotométrica não-específica de todas as proteínas a 280nm, o sinal da GFP foi gravado a 395nm (Fig.2), utilizando-se o detector de múltiplos comprimentos de onda (MWD). A maior parte da 6xHis-tagged-GFP se ligou à coluna, já que só um pequeno pico de GFP é visível na lavagem da coluna. Os resultados da purificação foram confirmados por SDS-Page (Fig.3). O lisado de células (Fig. 3, faixa 1) mostra uma banda proeminente representando o 6xHis GFP. Essa banda clareia na lavagem da coluna (Fig. 3, faixa 2), confirmando que a maior parte da proteína com tag se ligou à coluna. A amostra eluída (Fig.3, faixa 3) mostram a 6xHis-GFP (27kDa) purificada com apenas pequenas contaminações.

Materiais e métodos utilizados na aplicação FPLC
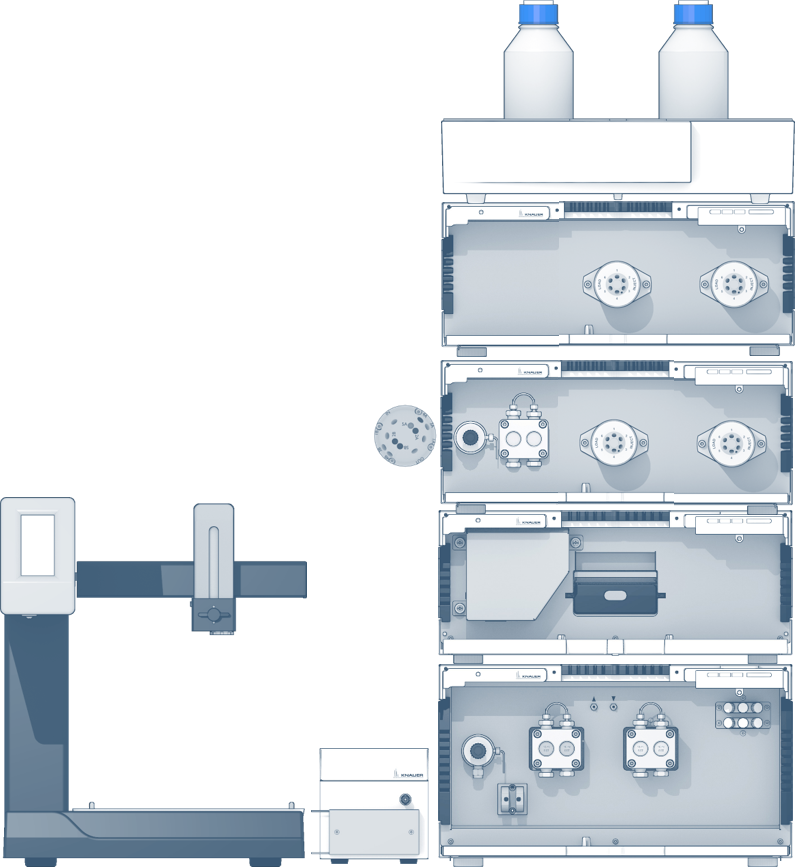
O sistema de purificação em 2 passos AZURA Bio LC com um detector de múltiplos comprimentos de onda (MWD) foi usado para essa aplicação. Esse sistema consiste de:
- Uma bomba binária AZURA P 6.1L HPG;
- Um assistente AZURA ASM 2.1L com uma bomba de alimentação e duas válvulas de injeção com 6 portas e 3 canais;
- Um segundo assistente AZURA ASM 2.1L com mais duas válvulas de injeção com 6 portas e 3 canais;
- Um detector MWD 2.1L;
- Uma válvula de seleção de coluna;
- Um monitor de condutividade;
- Um coletor de frações;
- Uma coluna ZetaSep NTA (Ni FF6) 1 mL
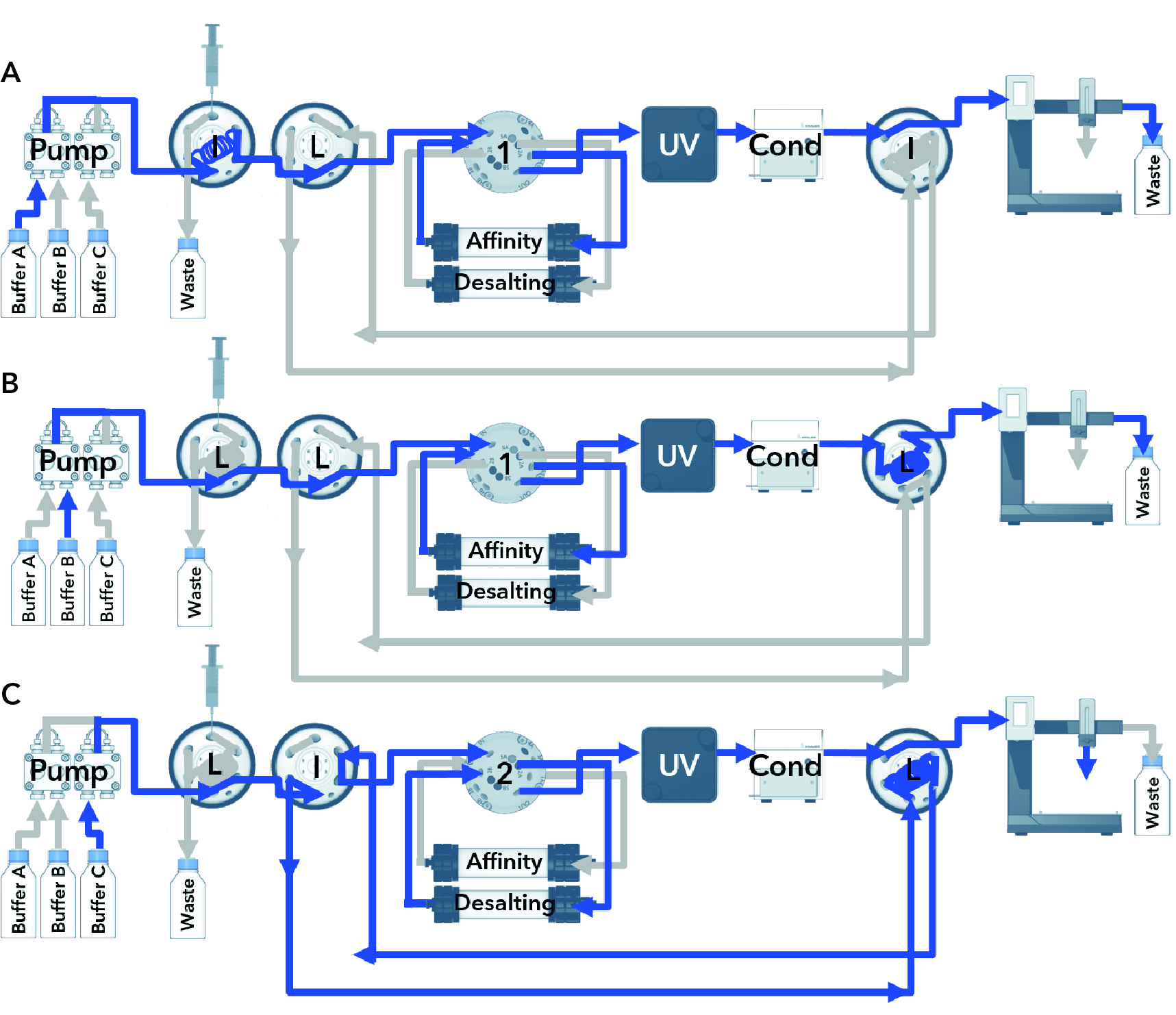
A coluna foi equilibrada antes da corrida com 15 mL de tampão para lavagem (PBS pH 7,5, imidazol 10 mM) à vazão de 1 mL/min. 100 µL de lisado contendo a 6xHis-GFP foi injetada na coluna a um fluxo de 0,3 mL/min. A coluna foi lavada com 4 mL de tampão PBS a vazão de 1mL/min. O tampão de lavagem tinha uma pequena quantidade de imidazol para reduzir a ligação não-específica de impurezas. A 6xHis-tagged GFP foi eluída com 5 mL de tampão de eluição (PBS, pH 7.5, 500 mM imidazol). E coletado em um loop de amostra de 1 mL.
A proteína eluída foi re-injetada em uma coluna de dessalinização de 5 mL para a troca do tampão de altas concentrações de imidazol do tampão de eluição para o tampão final de estocagem, sem imidazol. 7 mL de tampão de estocagem (PBS pH 7,4) foi usado para a filtração a gel a um fluxo de 1 mL/min. A proteína foi coletada em um coletor de frações. O sinal UV a 280nm e 395nm, assim como a condutividade, foram gravados.
Conclusão
A proteína 6xHis-tagged GFP foi purificada usando-se um protocolo automatizado em 2 passos. Combinando-se cromatografia de afinidade para capturar a proteína com uma subsequente troca de tampão para estocagem por cromatografia de exclusão de tamanho. Esta automatização dispensa qualquer interação manual, que em geral toma muito tempo. A configuração do método para uma purificação em dois passos é um ótimo exemplo e pode ser adaptada para diversos protocolos de purificação de proteínas. O benefício de um detector de múltiplos comprimentos de onda foi demonstrado medindo-se dois comprimentos de onda simultaneamente na mesma corrida.
Materiais adicionais e métodos
Parâmetros do método
| Eluente A | Tampão de lavagem: PBS (tampão salino de fosfato) pH 7,5, 10 mM imidazol | ||||||||||||||||||
| Eluente B | Tampão de eluição: PBS pH 7,5, 500 mM imidazol | ||||||||||||||||||
| Eluente C | Tampão de estocagem: PBS pH 7,4 | ||||||||||||||||||
| Gradiente |
| ||||||||||||||||||
| Vazão | 1 mL/min | ||||||||||||||||||
| Pressão de trabalho | 1,0 bar | ||||||||||||||||||
| Temperatura da coluna | temperatura ambiente | ||||||||||||||||||
| Tempo de corrida | 18 min | ||||||||||||||||||
| Volume de injeção | 100 µL | ||||||||||||||||||
| Modo de injeção | loop cheio | ||||||||||||||||||
| Comprimentos de onda | 280 nm, 395 nm | ||||||||||||||||||
| Constante de tempo | 500 ms |
Configurações do sistema e dados
| Instrumento | Descrição |
| Bomba | AZURA P 6.1L HPG, cerâmica, 50 mL |
| Detector | MWD 2.1L |
| Célula de fluxo | 10 mm, 1/16”, 10 µL, 300 bar, biocompatível |
| Assistente 1 | AZURA ASM 2.1L Esquerda: bomba de alimentação 50 ml Ti |
| Assistente 2 | AZURA ASM 2.1L Esquerda: – |
| Monitor de condutividade | AZURA CM 2.1S |
| Célula de fluxo | Preparativo, vazões até 100 mL |
| Válvula | Válvula de seleção de coluna |
| Coluna | ZetaSep NTA (Ni FF6) 1 mL ZetaSep FPLC Desalting column, 5 mL |
| Coletor de frações | Foxy R1 |
| Software | PurityChrom® 5 Upgrade |


